I.
PENGERTIAN SENYAWA ORGANOMETALIK
Senyawa Organometalik (Organologam) merupakan senyawa yang mengandung ikatan karbon
dengan logam (logam yang langsung terikat pada atom C yang membuat atom C
bermuatan negatif / karbanion). Atom logam (seperti Hg, Zn, Pb, Mg dan Li) atau
ke metaloid-metaloid tertentu (seperti Si, As dan Se).
II. REAKSI PEMBENTUKAN ORGANOMETALIK
Pada dasarnya Organologam prinsipnya yaitu atom-atom
Karbon dari gugus organik terikat kepada atom logam. Konsep ini yang mendasari
Organologam, sehingga banyak cara untuk menghasilkan ikatan-ikatan logam pada
Carbon yang berguna bagi kedua logam transisi dan non-transisi. Beberapa yang
lebih penting adalah sebagai berikut:
1. Reaksi Logam langsung ; sintesis yang
paling awal oleh ahli kimia Inggris, Frankland dalam tahun 1845 adalah
interaksi antara Zn dan suatu alkil Halida. Adapun yang lebih berguna adalah
penemuan ahli kimia Perancis, Grignard yang dikenal sebagai pereaksi Grignard.
Contohnya interaksi Magnesium dan alkil atau aril Halida dalam eter:
Mg + CH3I → CH3MgI
Interaksi langsung alkil atau aril Halida juga terjadi
dengan Li, Na, K, Ca, Zn dan Cd.
2. Penggunaan zat pengalkilasi.
Senyawa ini dimanfaatkan untuk membuat senyawa organologam lainnya. Kebanyakan
Halida nonlogam dan logam atau turunan Halida dapat dialkilasi dalam eter atau
pelarut hidrokarbon, misalnya :
PCl3 + 3C6H5MgCl →
P(C6H5)3 + 3MgCl2
VOCl3 + 3(CH3)3SiCH2MgCl
→ VO(CH2SiMe3)3 + 3MgCl2
3. Interaksi
Hidrida Logam atau nonlogam dengan alkena atau alkuna.
4. Reaksi Oksidatif adisi.
Reaksi yang dikenal sebagai reaksi Oksa dimana Alkil atau Aril Halida
ditambahkan pada senyawa logam transisi Koordinasi tidak jenuh menghasilkan
ikatan logam Karbon. Contohnya:
RhCl(PPh3)3 +
CH3I → RhClI(CH3)(PPh3)2 + PPh3
5. Reaksi Insersi yaitu reaksi
yang menghasilkan ikatan-ikatan dengan Karbon, sebagai contoh:
SbCl5 + 2HC CH→Cl3Sb(CH=CHCl)2
III.
REAKSI-REAKSI ORGANOMETALIK
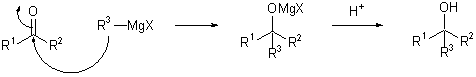
a) Reaksi Reagen Grignard
Reaksi Grignard
adalah reaksi kimia organologam di mana alkil - atau Aril-magnesium halides
(reagen Grignard) menambah gugus karbonil Aldehida atau keton. Reaksi ini
adalah alat penting untuk pembentukan ikatan antar karbon. Reaksi Halida
organik dengan magnesium bukan reaksi Grignard, tetapi menyediakan peraksi
Grignard. Pereaksi Grignard memiliki rumus umum RMgX dimana X adalah sebuah
halogen, dan R adalah sebuah gugus alkil atau aril (berdasarkan pada sebuah
cincin benzen). Pereaksi Grignard sederhana bisa berupa CH3CH2MgBr.
Sebuah contoh dari
reaksi grignard:
Reaksi dan
pereaksi Grignard ditemukan oleh dan diberi nama sesuai dengan penemunya
yaitu kimiawan Perancis François Auguste Victor Grignard (Universitas
Nancy, Perancis), yang dianugerahi Nobel Kimia tahun 1912 ini bekerja Grignard
reagen mirip dengan menghasilkan reagen karena keduanya nukleofil kuat yang
dapat membentuk ikatan antar karbon yang baru.
Reagen Grignard
berfungsi sebagai nukleofil, menyerang atom karbon elektrofilik yang hadir
dalam ikatan polar gugus karbonil. Penambahan pereaksi Grignard untuk karbonil
biasanya hasil melalui keadaan transisi enam-beranggota cincin.
Mekanisme dari
reaksi Grignard:
Namun,
dengan pereaksi Grignard terhalang, reaksi dapat melanjutkan dengan transfer
elektron tunggal. Jalur serupa diasumsikan untuk reaksi lain dari reagen
Grignard, misalnya, dalam pembentukan ikatan antara karbon-fosfor,
timah-karbon, karbon-silikon, boron-karbon dan karbon-heteroatom.
b) Reaksi Dengan Senyawa Karbonil

c) Reaksi Paling Sering antara Keton dan Aldehid
d) Reaksi dengan senyawa Elektrofilik Lainnya
e) Reaksi Oksidasi
IV.
JENIS-JENIS IKATAN
Terdapat beberapa kecenderungan jenis-jenis ikatan yang terbentuk pada senyawaan organologam:
a. Senyawaan ionik dari logam elektropositif
Garam
logam ion-ion karbon yang kestabilannya diperkuat oleh delokalisasi elektron
lebih stabil walaupun masih relatif reaktif. Adapun contoh gugus organik dalam
garam-garaman tersebut seperti (C6H5)3C-Na+ dan
(C5H5)2Ca2+.
b. Senyawaan yang memiliki ikatan -σ (sigma)
Senyawaan
organologam dimana sisa organiknya terikat pada suatu atom logam
dengan suatu ikatan yang digolongkan sebagai ikatan kovalen (walaupun masih ada
karakter-karakter ionik dari senyawaan ini) yang dibentuk oleh kebanyakan logam
dengan keelektropositifan yang relatif lebih rendah dari golongan pertama di
atas,
Pada
dasarnya Organologam prinsipnya yaitu atom-atom Karbon dari gugus organik
terikat kepada atom logam. Konsep ini yang mendasari Organologam, sehingga
banyak cara untuk menghasilkan ikatan-ikatan logam pada Carbon yang berguna
bagi kedua logam transisi dan non-transisi. Beberapa yang lebih penting adalah
sebagai berikut:
1. Reaksi Logam langsung ; sintesis yang paling awal oleh ahli kimia Inggris,
Frankland dalam tahun 1845 adalah interaksi antara Zn dan suatu alkil
Halida. Adapun yang lebih berguna adalah penemuan ahli kimia Perancis, Grignard
yang dikenal sebagai pereaksi Grignard. Contohnya interaksi Magnesium dan alkil
atau aril Halida dalam eter:
Mg + CH3I → CH3MgI
Interaksi
langsung alkil atau aril Halida juga terjadi dengan Li, Na, K, Ca, Zn dan Cd.
2. Penggunaan
zat pengalkilasi. Senyawa ini dimanfaatkan untuk membuat senyawa organologam
lainnya. Kebanyakan Halida nonlogam dan logam atau turunan Halida dapat
dialkilasi dalam eter atau pelarut hidrokarbon, misalnya :
PCl3 + 3C6H5MgCl →
P(C6H5)3 + 3MgCl2
VOCl3 + 3(CH3)3SiCH2MgCl
→ VO(CH2SiMe3)3 + 3MgCl2
3. Interaksi
Hidrida Logam atau nonlogam dengan alkena atau alkuna.
4. Reaksi
Oksidatif adisi. Reaksi yang dikenal sebagai reaksi Oksa dimana Alkil atau Aril
Halida ditambahkan pada senyawa logam transisi Koordinasi tidak jenuh
menghasilkan ikatan logam Karbon. Contohnya:
RhCl(PPh3)3 + CH3I
→ RhClI(CH3)(PPh3)2 + PPh3
5. Reaksi
Insersi yaitu reaksi yang menghasilkan ikatan-ikatan dengan Karbon, sebagai
contoh:
SbCl5 + 2HC CH→Cl3Sb(CH=CHCl)2
Terdapat dua macam ikatan organologam, yaitu :
·Ikatan ionik. Ikatan ionik organologam
terbentuk dari unsur yang sangat elektropositif yaitu unsur pada golongan I,
II, dan III. Organologam dengan yang berikatan secara ionik bersifat tak larut
dalam pelarut hidrokarbon dan mudah teroksidasi.
·
Ikatan kovalen. Ikatan kovalen organologam yang mudah
menguap terbentuk dari logam Zn, Cd, Hg, dan logam non-transisi gologan III
(kecuali aluminium), IV, dan V. Ikatan kovalen ini terbentuk dengan cara
memberikan satu elektron tunggalnya, baik dari logam maupun unsur organiknya,
untuk dipakai secara bersama. Sifat dari senyawa organologam dengan ikatan
kovalen ini mudah menguap, larut dalam pelarut organik, dan tidak larut dalam
air.
V.
PERMASALAHAN
1. Apa
fungsi reagen Grignard ? Jelaskan !
2. Bagaimana cara
pembentukan ikatan kovalen pada organologam ? serta sebutkan sifat-sifat
senyawa organologam !
3. Jelaskan
manfaat dari penggunaan zat pengalkilasi !